Concepto de partes por millón, ppm
$$ ppm=\frac{parte\,de\,volumen\,aire\,contaminado}{un\,millón\,de\,partes\,de\,aire}=\frac{1}{1000000} $$
$$ ppm=\frac{volumen\,contaminante}{volumen\,total\,de\,aire}*10^6$$
¿Qué significa 400 ppm de CO2?
Significa que 1L de aire contiene 400 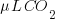
Significa que hay 400 mol de 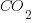 en
en 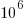 mol de aire
mol de aire
Concentración en aire ambiente para contaminantes gaseosos a partir de la Ley de los Gases Ideales
$$PV=nRT $$
P es la presión atmosférica en unidades de atm
V es el volumen del analito en unidades de L
n es el número de mol del analito en unidades de mol
T es la temperatura ambiental en K
R es la CTE de los gases ideales ![0.0821delim{[}{{atm L}/{K mol}}{]} 0.0821delim{[}{{atm L}/{K mol}}{]}](https://gilbertofuentesg.com/wp-content/plugins/wpmathpub/phpmathpublisher/img/math_981_703c51ad2e2b1c7e489624620deceae0.png)
Volumen molar
$$ V_M= \frac{V}{n} = \frac{{R}{T}}{P} $$
$$ V_M= \frac{L}{mol} $$
Masa molecular del analito
$$ PM= \frac{masa_{analito}}{mol} $$
$$ PM= \frac{g}{mol} $$
Relacionando el volumen molar y la masa molecular
$$ \frac{V_M}{PM} = \frac{\frac{L}{mol}}{\frac{g}{mol}} \implies \frac{L}{g} \implies llegar\,a\,ppm? $$
Entonces:
$$ \left[\frac{L}{g}\right] \left[\frac{m^3}{1000L}\right] \left[\frac{g}{1000mg}\right] \left[\frac{mg}{m^3}\right] = \frac{1}{1000000} = ppm $$
Por lo que,
$$ ppm = \frac{V_M}{PM} \left[\frac{mg}{m^3}\right] $$
$$ \frac{mg}{m^3} = \frac{\left({ppm}\right)\left({PM}\right)}{V_M} $$
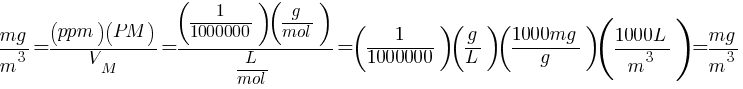
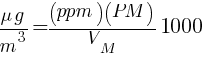
Volumen molar a condiciones de referencia y condiciones normales (estandar)
Condiciones de referencia es a 25ºC y 1atm
El volumen molar a condiciones de referencia:
![V_{M}=V/n=RT/P={0.0821delim{[}{{atm L}/{K mol}}{]}(298K)}/{1atm}=24.4658L/mol V_{M}=V/n=RT/P={0.0821delim{[}{{atm L}/{K mol}}{]}(298K)}/{1atm}=24.4658L/mol](https://gilbertofuentesg.com/wp-content/plugins/wpmathpub/phpmathpublisher/img/math_982_7a15ac58580a9b51bee4a02148407d96.png)
Condiciones de estandar es a 0ºC y 1atm
El volumen molar a condiciones estandar:
![V_{M}=V/n=RT/P={0.0821delim{[}{{atm L}/{K mol}}{]}(273K)}/{1atm}=22.4133L/mol V_{M}=V/n=RT/P={0.0821delim{[}{{atm L}/{K mol}}{]}(273K)}/{1atm}=22.4133L/mol](https://gilbertofuentesg.com/wp-content/plugins/wpmathpub/phpmathpublisher/img/math_982_076b8969fa60e21ff53473ce504f6a08.png)
Resuelve:
En un laboratorio de 4 metros x 3.5 metros x 3 metros se produjo una fuga de cloroformo de 50 cm3, la temperatura que se registro fue de 26 ºC y una presión atmosférica de 585 mmHg . Determina la concentración ambiental en ppm y mg/m3 de cloroformo que permaneció en el laboratorio durante 1 hora.
Luego de haber hecho burbujear 15 L de aire a un filtro ambiental, se encontró una concentración de 0.015 mg/cm3 de ácido clorhídrico (HCl) a través del análisis químico. El volumen que se utilizó para la disolución de la muestra fue de 50 cm3. Las condiciones ambientales del muestreo fueron de 25 ºC y 755 mmHg. Determina la concentración ambiental de HCl en ppm y en mg/m3.
Se realizó un muestreo de aire en una mina subterránea a flujo continuo de 4.2 L/min, mediante una bomba de aire, en un periodo de 3.5 horas. El aire se hizo burbujear sobre un filtro ambiental de 150 cm3 con una disolución absorbente, y el análisis químico de la muestra indicó una concentración en disolución de monóxido de carbono (CO) de 0.345 mg/cm3. La temperatura ambiental y presión atmosférica del muestreo fueron de 30 ºC y 760 mmHg. Determina la concentración ambiental de CO en ppm y mg/m3.
I appreciate your piece of work, appreciate it for all the useful content.